整合到基因组中的逆转录病毒有助抵抗HIV-1感染
- 生物谷
- chain2012
- 2017-07-20 16:41:38
-在我们的进化过程中,病毒持续地感染人体。一些早期的病毒已整合到我们的基因组中,如今它们被称作为人内源性逆转录病毒(human endogenous retroviruses, HERV)。在上百万年来,它们因它们的遗传密码发生突变或较大的缺失而变得没有活性。如今,作为研究得最多的HERV家族之一是HERV-K家族,该家族自从人类和黑猩猩在进化上分开以来就变得活跃,而且它的一些成员在过去几十万年里可能活跃地感染人类。
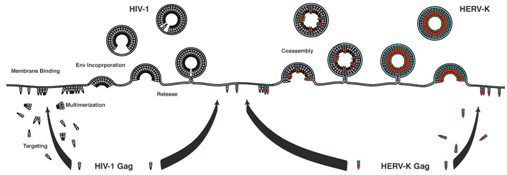
HERV成为HIV研究人员的关注目标是因为已有研究证实在那些HIV感染者中,T细胞产生抵抗HERV的免疫反应。如今,据认为HERV表达是由HIV感染导致的,而且通过靶向HERV抗原而不是不断发生突变的HIV抗原,HIV将变成一种更容易的靶标。在提出这种看法之后,日本熊本大学之前开展的一项研究已揭示出HIV-1组特异性抗原(group specific antigen, Gag)和HERV-K Gag共组装与HIV-1颗粒增殖能力和感染性下降存在明显的关联性。在当前的一项新的研究中,来自熊本大学的这些研究人员寻求阐明HERV-K Gag如何以这种方式影响HIV-1。
他们报道在早期的共组装阶段,HERV-K Gag改变后代HIV-1颗粒的大小和形态。这发生的原因在于HERV-K Gag衣壳(即HERV-K病毒蛋白衣壳)部分上与HIV-1 Gag在细胞膜上共定位(或者说重叠)。这也会导致成熟的HIV-1颗粒数量下降、HIV-1更慢地释放和感染性下降。相关研究结果近期发表在Retrovirology期刊上,论文标题为“Molecular mechanisms by which HERV-K Gag interferes with HIV-1 Gag assembly and particle infectivity”。
论文通信作者、熊本大学生命科学学院微生物学系项目领导者Kazuaki Monde博士说,“尽管我们发现HIV-1颗粒的释放效率和感染性受到HERV-K Gag的阻碍,但是它们似乎是由两种不同的机制导致的。也表达HERV-K Gag的细胞释放HIV-1颗粒的能力显著下降,但是HIV-1感染性如何也会下降的细节仍然让我们困惑。当然,还需针对HERV-K Gag衣壳开展更多的研究以便确定它如何能够降低HIV-1颗粒释放和感染性。”

