Nat Commun:揭示蛋白APOBEC3G抑制HIV-1的两种不同机制
- 生物谷
- 2017-10-16 19:31:53
15年前,人们发现一类被称作APOBEC3的蛋白让人类对HIV-1产生先天性免疫力。不幸的是,HIV-1是一种聪明的病毒。它经过进化后,能够抵抗这些蛋白。在一项新的研究中,来自美国东北大学、俄亥俄州立大学和加拿大萨斯喀彻温大学的研究人员通过多年来对这些蛋白的研究,有助进一步理解它们的功能和机制,从而有望更好地抑制HIV-1。他们研究了人蛋白APOBEC3G(A3G)抑制HIV-1的能力。相关研究结果于2017年9月19日在线发表在Nature Communications期刊上,论文标题为“Dimerization regulates both deaminase-dependent and deaminase-independent HIV-1 restriction by APOBEC3G”。论文通信作者为东北大学物理学教授和主任Mark Williams。论文第一作者为东北大学的博士后研究员Mike Morse。
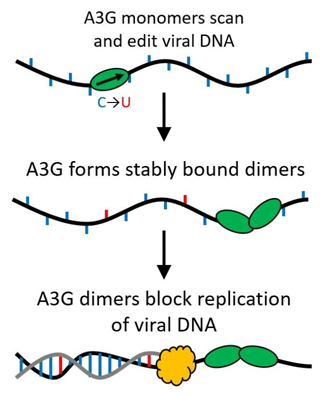
他们的发现表明当A3G从单个蛋白(单体)变成双蛋白复合物(二聚体)时,它的功能从一种让病毒DNA发生突变的编辑蛋白转化为一种阻止这种病毒进一步复制的路障。
过去12年来,Williams实验室一直在研究HIV-1复制。他们的近期研究涉及理解这些让人类对HIV-1产生免疫力的先天性免疫蛋白。在APOBEC3蛋白家族中,存在7种蛋白:APOBEC3A、APOBEC3B、APOBEC3C、APOBEC3D/ APOBEC3E、APOBEC3F、APOBEC3G、APOBEC3H,其中的一些蛋白抵抗HIV-1等逆转录病毒,而其他的蛋白抵抗逆转录转座子(retrotransposon),即在基因组中自我扩增且有潜力导致疾病的序列元件。
所有的APOBEC蛋白(包括APOBEC1、APOBEC2、APOBEC3、APOBEC4)都是胞苷脱氨酶,这就允许它们对单链DNA进行修饰来替代碱基,从而使得这种单链DNA当发生复制时会产生突变。然而,A3G也具有另一种完全相反的功能:它能够成为一种稳定的结合蛋白,抑制这种逆转录过程发生,从而阻止HIV-1复制,而不是沿着基因组快速地移动进行编辑。这会发生的原因在于一种被称作寡聚化的过程,即单个蛋白单元(单体)连接在一起,形成多蛋白复合物或者说寡聚物。
Williams说,“它们可以快速地移动,产生这些变化,同时也阻挡了其他东西的移动,这实际上是没有意义的。这就是寡聚化是如此重要的原因。当它们开始快速地移动时,它们随着时间的推移发生寡聚化,移动得非常缓慢。”
这些研究人员在2014年开展的一项研究中发现了这种寡聚化过程(Nature Chemistry, January 2014, doi:10.1038/nchem.1795)。他们证实了一种多蛋白复合物的产生导致这种蛋白缓慢地移动,但是并不清楚的是,产生一种缓慢移动的复合物需要多少蛋白。如果需要的蛋白数量较高的话,那么结果可能与病毒复制不相关。此外,他们能够证实这些蛋白复合物缓慢地移动,但是他们无法判断这些缓慢移动的蛋白复合物是否具有酶活性。但是如今,他们的新研究找到了这两个关键问题的答案。
Morse说,“在我们直接观察蛋白A3G结合到DNA上的实验中,以及在萨斯喀彻温大学的Linda Chelico教授对A3G的酶活性的研究中,我们发现在短时间内,单体形式的这种蛋白结合到DNA上并且快速地与它分离开,而且具有很高的酶活性。但是一旦让它形成这些寡聚物,这种结合变得更加稳定,不会轻易地分离。Chelico教授能够发现当这种过程发生时,这种酶活性实际上会下降,因此这种蛋白具有两种功能:在单体形式下,它具有酶活性;第二种功能是由于寡聚化而产生的。”
他们的研究表明即便仅两个蛋白A3G连接在一起形成二聚体,这种情况也会发生。这种二聚体足以让这种蛋白复合物保持稳定,并改变它的功能。鉴于仅需一种二聚体,就可形成多种路障来阻止逆转录发生。如今,这种重要的功能可能具有生物学上的意义。
Williams说,“了解如何抑制HIV-1可能有助为设计抗HIV药物的新方法提供指导。HIV-1产生它自己的蛋白来诱导细胞降解APOBEC蛋白,因此,我们能够找到阻止这种降解的方法,那么我们可能能够增强它们抑制HIV-1的能力。”

