J Infect Dis:利用保护性HLA单体型控制HIV-1复制
- 生物谷
- 2017-12-19 23:24:57
20%的日本人口拥有一组遗传自单亲的与溃疡性结肠炎和大动脉炎(Takayasu arteritis)存在关联的基因(单体型)。人们已知这些单体型具有抵抗HIV-1的作用。
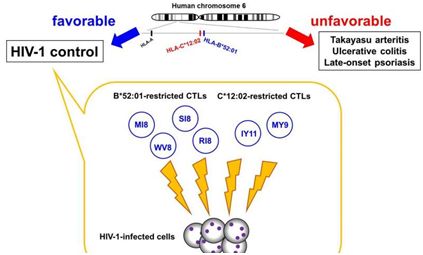
日本熊本大学艾滋病研究中心的研究人员之前已发现相比于不携带HLA-B*52:01和HLA-C*12:02单体型的患者,携带这两种单体型的患者具有更低的血浆病毒载量(plasma viral load, pVL)和更高的CD4 T细胞计数,而且HLA-B*52:01能够通过产生HIV-1特异性的细胞毒性T细胞(CTL)来抑制HIV-1复制。然而迄今为止,HLA-C等位基因及其相关的CTL控制HIV-1复制的直接证据仍然是缺乏的。
图片来自Masafumi Takiguchi教授。
在之前针对自然杀伤细胞(NK细胞)的一项研究中,这些来自熊本大学的研究人员发现携带着HLA-C*12:02和KIR2LD2(为HLA-C*12:02的受体)的HIV-1感染者要比携带着其中的一种或者两者都不携带的感染者具有更低的血浆病毒载量。他们指出与HLA-B一样,HLA-C也在调节HIV-1中发挥着作用。然而,由于这两个等位基因存在着较强的连锁性,区分哪种等位基因影响HIV-1复制是很难的。
为了克服这个问题,在一项新的研究中,这些研究人员寻找抗原的特定部分(T细胞表位)以便确定哪种T细胞表位对HLA-C*12:02单体型产生最强的免疫反应。他们在遭受HIV-1感染的携带着HLA-C*12:02的日本人群中,鉴定出Nef MY9和Pol IY11是免疫显性表位,由此表明HLA-C成为HLA-B控制感染者中的HIV-1复制的有力补充。相关研究结果发表在2017年12月12日的Journal of Infectious Diseases期刊上,论文标题为“Control of HIV-1 by an HLA-B*52:01-C*12:02 Protective Haplotype”。
论文通信作者、熊本大学教授Masafumi Takiguchi 说,“不幸的是,这种单体型与日本人群中的其他几种疾病存在关联。尽管它们能够明显地控制HIV-1,但是当免疫反应太强时,它们也能够导致其他的自身免疫疾病,甚至过敏症。”

