葛兰素史克首创附着抑制剂Rukobia在欧盟即将获批,全新抗HIV机制
- 药时空
- 药时空
- 2020-12-18 20:45:00
ViiV Healthcare是一家由葛兰素史克(GSK)控股、辉瑞(Pfizer)和盐野义(Shionogi)持股的HIV/AIDS药物研发公司。近日,该公司宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极审查意见,建议批准Rukobia(fostemsavir)600mg缓释片,联合其他抗逆转录病毒(ARV)药物,用于治疗无法构建抑制性抗病毒方案的多重耐药HIV-1成人感染者。Rukobia是一种治疗HIV-1感染的新型附着抑制剂。今年6月,Rukobia获得美国FDA批准,适应症为:联合其他ARV药物,用于治疗曾尝试过多种HIV疗法(heavily treatment-experienced,HTE)、并且由于耐药/不耐受或安全性的考虑而对其当前ARV方案治疗失败的多重耐药HIV-1成人感染者。在关键III期BRIGHT研究中,大多数(60%)HTE多重耐药HIV-1成人感染者接受Rukobia和优化的背景治疗后,实现并维持病毒抑制直至96周,且CD4+T细胞技术有临床意义的改善。过去几十年来的重大进展极大地改善了HIV的治疗,对许多患者来说,HIV被认为是一种可控的终生疾病。然而,由于耐药、耐受性或安全性的考虑,HTE成人患者(约占HIV感染者的6%)几乎没有或没有选择余地,有AIDS病情进展和死亡的风险,迫切需要额外的治疗方案。Rukobia的批准上市,将为那些由于各种原因而无法用现有药物抑制和维持病毒抑制的HTE多重耐药HIV-1成人感染者,提供一个重要的治疗选择。此前,美国FDA已授予Rukobia快速通道资格、优先审查资格、突破性药物资格。欧盟EMA已授予Rukobia加速评估资格。 Rukobia的活性药物成分为fostemsavir,这是一种首创的(first-in-class)HIV-1附着抑制剂。fostemsavir是temsavir的一种前药,通过口服后,fostemsavir可转变为temsavir,然后被吸收并通过直接附着在病毒表面糖蛋白120(gp120)亚基发挥抗病毒作用。通过与病毒上的这个位置结合,temsavir可阻止HIV病毒附着到宿主免疫系统CD4+T细胞和其他免疫细胞上,并防止HIV病毒感染这些细胞并增殖。由于Rukobia是第一个针对病毒周期中第一步(附着)的抗逆转录病毒疗法,因此对其他种类的抗逆转录病毒药物没有显示出耐药性,这可能帮助对大多数其他药物产生耐药性的HIV感染者。在过去30年里,HIV治疗方面取得了令人难以置信的进步。抗逆转录病毒药物能够有效抑制HIV,这有助于减少疾病进展、HIV传播和与艾滋病有关的死亡,但由于HIV具有不断变化的能力,一些患者可能对抗逆转录病毒药物产生耐药性,导致其治疗方案失败。在耐受性、安全性和药物相互作用方面的挑战,可能会进一步减少在设计有效治疗方案时可接受的抗逆转录病毒疗法的数量。对于既往接受过多种方案并且无法成功抑制HIV的多重耐药患者群体而言,仍然存在着显著未得到满足的医疗需求。来自Rukobia临床开发项目的疗效和安全性研究结果表明,该药对于需要新治疗方案的多重耐药HIV感染者具有独特的潜力。Rukobia的批准上市,将提供一种全新的方法,来帮助这类患者实现对病毒的抑制。
Rukobia的活性药物成分为fostemsavir,这是一种首创的(first-in-class)HIV-1附着抑制剂。fostemsavir是temsavir的一种前药,通过口服后,fostemsavir可转变为temsavir,然后被吸收并通过直接附着在病毒表面糖蛋白120(gp120)亚基发挥抗病毒作用。通过与病毒上的这个位置结合,temsavir可阻止HIV病毒附着到宿主免疫系统CD4+T细胞和其他免疫细胞上,并防止HIV病毒感染这些细胞并增殖。由于Rukobia是第一个针对病毒周期中第一步(附着)的抗逆转录病毒疗法,因此对其他种类的抗逆转录病毒药物没有显示出耐药性,这可能帮助对大多数其他药物产生耐药性的HIV感染者。在过去30年里,HIV治疗方面取得了令人难以置信的进步。抗逆转录病毒药物能够有效抑制HIV,这有助于减少疾病进展、HIV传播和与艾滋病有关的死亡,但由于HIV具有不断变化的能力,一些患者可能对抗逆转录病毒药物产生耐药性,导致其治疗方案失败。在耐受性、安全性和药物相互作用方面的挑战,可能会进一步减少在设计有效治疗方案时可接受的抗逆转录病毒疗法的数量。对于既往接受过多种方案并且无法成功抑制HIV的多重耐药患者群体而言,仍然存在着显著未得到满足的医疗需求。来自Rukobia临床开发项目的疗效和安全性研究结果表明,该药对于需要新治疗方案的多重耐药HIV感染者具有独特的潜力。Rukobia的批准上市,将提供一种全新的方法,来帮助这类患者实现对病毒的抑制。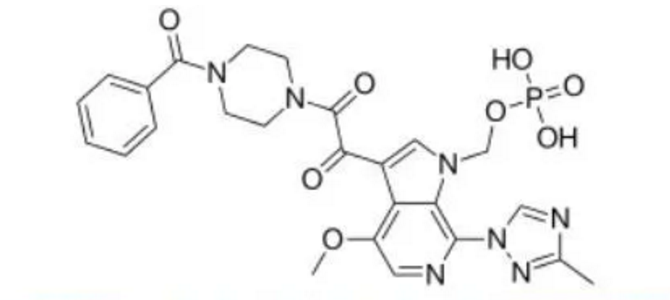
 CHMP的积极审查意见,基于在HTE多重耐药HIV患者中开展的关键III期BRIGHT研究(NCT02362503)的数据。该研究的96周结果于2019年7月在墨西哥城举办的2019国际艾滋病学会艾滋病科学会议(IAS 2019)上公布。BRIGHT是一项2个队列(随机和非随机)研究,评估了HIV-1附着抑制剂fostemsavir在既往已过度治疗(HTE)的HIV-1成人感染者中的安全性和有效性。研究共入组了371例患者,这些患者尽管服用抗逆转录病毒(ARV)药物但血液中的病毒(HIV-RNA)水平仍然很高。大多数患者接受HIV治疗超过15年(71%)、在进入试验前曾接受过5种或更多种不同的HIV治疗方案(85%)和/或有艾滋病史(86%)。所有患者均记录有对目前可用的6类ARV药物中的4类具有耐药性、不可耐受性和/或禁忌症。在随机队列(n=272)中,患者在基线时必须对1类但不超过2类ARV药物保持完全活性,并且不能从其剩余的药物中形成可行的ARV方案。这些患者以3:1的比例进行随机分配,在其当前失败的治疗方案中盲法加入fostemsavir或安慰剂(n=272),进行持续8天的功能性单药治疗。针对已批准ARV无任何剩余完全活性的患者(n=99)被分配进入非随机队列,并在第1天接受开放标签fostemsavir及优化的背景治疗(OBT)。研究的主要终点是随机队列log10 HIV-1 RNA在第1天与第8天之间的平均变化。在8天双盲期之后,随机队列所有患者接受开放标签fostemsavir和优化的背景治疗。关键的次要终点包括第24、48、96周反应的持久性,以及CD4+细胞技术从基线的安全变化和病毒耐药性的出现。结果显示,根据随机队列中从第1天到第8天HIV-1 RNA经调整后的平均下降,主要终点分析显示fostemsavir优于安慰剂(分别下降0.79和0.17 log10 c/mL;p<0.0001,意向性治疗-暴露[ITT-E]人群)。在随机队列中,在这种难以治疗的多药耐药HIV-1患者群体中,病毒学抑制和免疫应答率从24周至96周继续增加。具体数据:随机队列中接受fostemsavir与优化背景疗法(OBT)治疗的患者中,治疗第24、48周、96周实现病毒学抑制(HIV-1 RNA<40拷贝/毫升[c/ml])的患者比例分别为53%、54%、60%(n=163/272)。随时间推移,患者表现出持续的免疫改善,CD4+细胞计数的平均变化持续增加(第24周、48周、96周分别增加90个、139个、205个细胞/微升)。研究中,最常见的不良反应(≥5%,所有级别)是恶心和腹泻。至第96周,因不良事件而停止fostemsavir治疗的患者比例为7%(随机:5%,非随机:2%)。
CHMP的积极审查意见,基于在HTE多重耐药HIV患者中开展的关键III期BRIGHT研究(NCT02362503)的数据。该研究的96周结果于2019年7月在墨西哥城举办的2019国际艾滋病学会艾滋病科学会议(IAS 2019)上公布。BRIGHT是一项2个队列(随机和非随机)研究,评估了HIV-1附着抑制剂fostemsavir在既往已过度治疗(HTE)的HIV-1成人感染者中的安全性和有效性。研究共入组了371例患者,这些患者尽管服用抗逆转录病毒(ARV)药物但血液中的病毒(HIV-RNA)水平仍然很高。大多数患者接受HIV治疗超过15年(71%)、在进入试验前曾接受过5种或更多种不同的HIV治疗方案(85%)和/或有艾滋病史(86%)。所有患者均记录有对目前可用的6类ARV药物中的4类具有耐药性、不可耐受性和/或禁忌症。在随机队列(n=272)中,患者在基线时必须对1类但不超过2类ARV药物保持完全活性,并且不能从其剩余的药物中形成可行的ARV方案。这些患者以3:1的比例进行随机分配,在其当前失败的治疗方案中盲法加入fostemsavir或安慰剂(n=272),进行持续8天的功能性单药治疗。针对已批准ARV无任何剩余完全活性的患者(n=99)被分配进入非随机队列,并在第1天接受开放标签fostemsavir及优化的背景治疗(OBT)。研究的主要终点是随机队列log10 HIV-1 RNA在第1天与第8天之间的平均变化。在8天双盲期之后,随机队列所有患者接受开放标签fostemsavir和优化的背景治疗。关键的次要终点包括第24、48、96周反应的持久性,以及CD4+细胞技术从基线的安全变化和病毒耐药性的出现。结果显示,根据随机队列中从第1天到第8天HIV-1 RNA经调整后的平均下降,主要终点分析显示fostemsavir优于安慰剂(分别下降0.79和0.17 log10 c/mL;p<0.0001,意向性治疗-暴露[ITT-E]人群)。在随机队列中,在这种难以治疗的多药耐药HIV-1患者群体中,病毒学抑制和免疫应答率从24周至96周继续增加。具体数据:随机队列中接受fostemsavir与优化背景疗法(OBT)治疗的患者中,治疗第24、48周、96周实现病毒学抑制(HIV-1 RNA<40拷贝/毫升[c/ml])的患者比例分别为53%、54%、60%(n=163/272)。随时间推移,患者表现出持续的免疫改善,CD4+细胞计数的平均变化持续增加(第24周、48周、96周分别增加90个、139个、205个细胞/微升)。研究中,最常见的不良反应(≥5%,所有级别)是恶心和腹泻。至第96周,因不良事件而停止fostemsavir治疗的患者比例为7%(随机:5%,非随机:2%)。
文章来源:
https://www.businesswire.com/news/home/20200702005577/en/ViiV-Healthcare-Announces-FDA-Approval-Rukobia-fostemsavir




