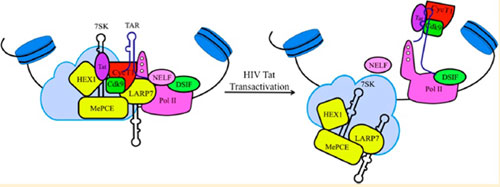
不久之前,科学家们发现HIV病毒的自我复制,其实是需要接管人类宿主的翻译蛋白系统才能完成它的自我复制。其中一个非常关键的名叫P-TEFb的蛋白复合物在和HIV RNA结合之后,能够磷酸化核糖体,继而完成信使RNA的转录。这个P-TEFb蛋白复合物实际上是和人类自己的7SK RNA是结合在一起的,所以说HIV进化出了一个名叫Tat的蛋白,于是可以从7SK RNA中抢夺P-TEFb。但是,其中的具体机理一直不为人知。
在美国化学学会出版的《生物化学》期刊的2014年2月版中,来自中国的生物学者卢佳博士、夏天斌博士和齐欣博士等人发表了《Tat的结合使7SK RNA产生了特异的结构变化》一文。在文中,卢佳博士、夏天斌博士和齐欣博士利用了一种非常特殊的飞秒激光荧光光度计(北美只有四、五所高校研究所拥有此种高端光度计),对7SK RNA和HIV TAR RNA构象结构的总体进行了分析,进而发现在Tat蛋白存在下这两种RNA的异同点。 根据其差异所在,研究结果不但补充了HIV RNA结构研究的理论基础,也给抗艾滋病药物的研发提供了一个新的思路。
目前,根据世界卫生组织的报告,全世界至少有3300万人携带有HIV病毒。现有的大部分艾滋病药物都会对人体产生副作用,而这次卢佳博士等人发现的结构不同点能够给新药研发提供一个崭新的平台。通过弥补现有艾滋病药物只针对其蛋白序列而不是针对蛋白构型的缺陷,此次的发现能够推动新的抗艾滋病药物的研发,进而推动全世界在治疗艾滋病领域的发展。
|
| 图为艾滋病毒接管宿主核糖体并自我复制 [保存到相册] |

1
|
| 图为美国化学学会官网刊登的论文信息 [保存到相册] |

